RESUMEN/ASPECTOS DESTACADOS INFORME GENESIS*
La combinación de trastuzumab con fluoropirimidina más platino representa la terapia estándar (SOC) para el abordaje de primera línea del ACG o de la UGE localmente avanzado o metastásico HER2 positivo. Sin embargo, el pronóstico sigue siendo malo y hasta el estudio analizado en este informe (KEYNOTE-811) no existían otras opciones terapéuticas.
Pembrolizumab es un anticuerpo monoclonal humanizado de isotipo IgG4/kappa dirigido contra PD-1. Al bloquear la interacción entre PD-1 y sus ligandos PD-L1/2, potencia la actividad de los linfocitos T con la consiguiente estimulación de la actividad antitumoral mediada por el sistema inmunitario. También modula el nivel de IL-2, TNFα, IFNγ y otras citocinas. Pembrolizumab potencia las respuestas inmunitarias existentes únicamente en presencia de antígeno; no activa de forma inespecífica las células T.
Características de la población analizada en el estudio KEYNOTE-811 (Estudio pivotal):
|
Eficacia
De acuerdo con el segundo análisis intermedio (AI2) del ensayo pivotal, doble ciego, fase III KEYNOTE-811, el tratamiento con pembrolizumab en combinación con trastuzumab, fluoropirimidina y quimioterapia que contenga platino mostró una mejora estadísticamente significativa frente al estándar en la covariable principal supervivencia libre de progresión (SLP): HR 0,72 (IC95 0,60-0,87). La otra covariable principal, supervivencia global (SG), no alcanzó la significación preespecificada en el AI2, publicado en el EPAR1, ni en el AI32, publicado con posterioridad. En este último, se obtuvo un HR=0,84 (IC95% 0,70–1,01). para SG. Se espera que próximamente se publique el análisis final de SG. En PD-L1 CPS≥1% -análisis no preespecificado como variable en esta población; sí como análisis de subgrupos-, el AI2 mostró un HR 0,79 (IC95% 0,64-0,98) para SG, frente a un HR 1,16 en CPS<1%. Esto motivó la autorización en PD-L1 CPS≥1% En el AI3, más maduro, se obtuvo un resultado muy similar para la misma población, HR 0,81 (IC95% 0,67-0,98). El beneficio en SG determinado por diferencia de medianas fue de 4,3 meses (20,0 vs. 15,7).
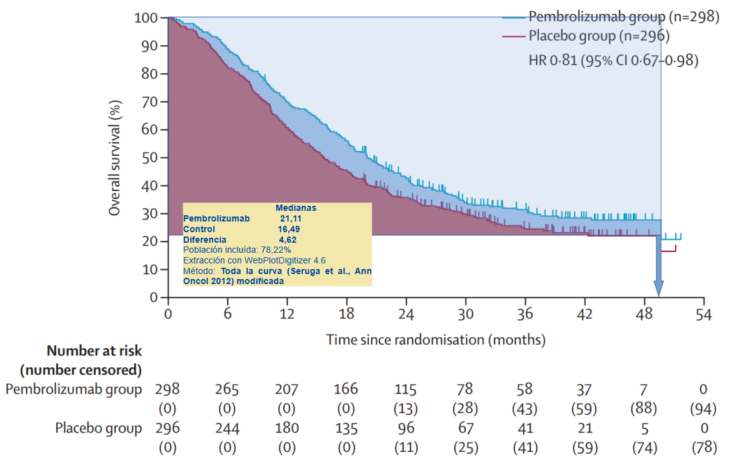
Se estimó, a partir del AI3, el beneficio en SG por áreas bajo la curva (AUC) mediante el cálculo por media restringida, teniendo en cuenta toda la curva, por el método de Seruga et al.3 modificado, obteniéndose un beneficio de 4,62 meses con un 78,22% de pacientes aportando datos de tiempo hasta el evento. Teniendo en cuenta que este método se ajusta bien a nuestras curvas, podríamos concluir que la diferencia de medianas podría ser una buena valoración del beneficio neto (fig. 1).
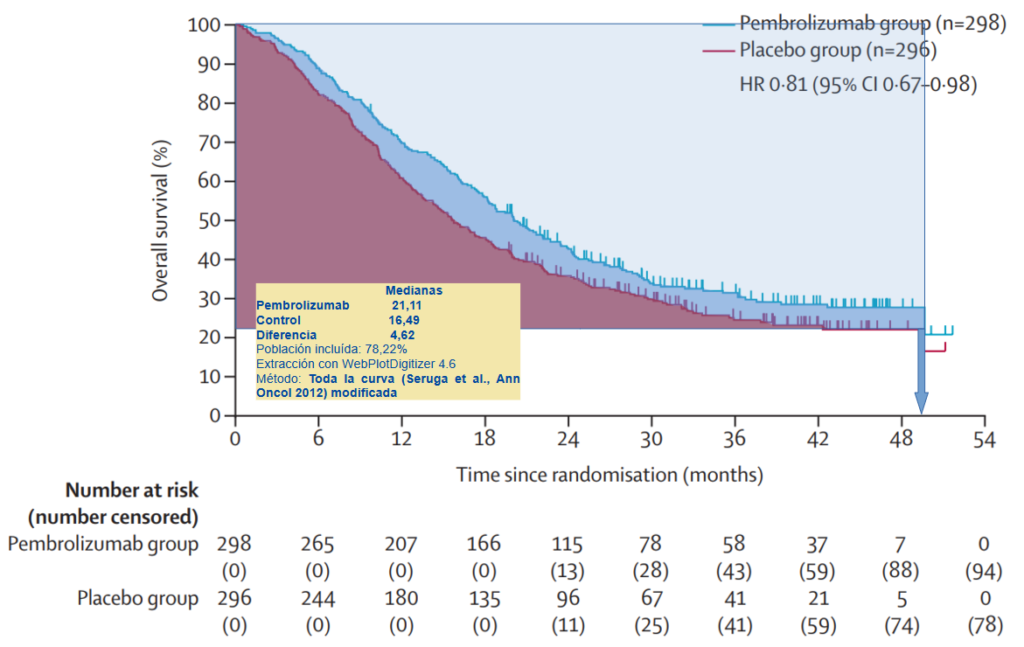
Figura 1. Estimación del beneficio en supervivencia de pembrolizumab + SOC vs. control en pacientes con ACG y de la UGE localmente avanzado o metastásico HER2 positivo con PD-L1 positivo (CPS≥1). Cálculo por media restringida (toda la curva; método de Seruga et al., Ann Oncol 2012 modificado).
La figura 2 muestra el análisis forest-plot por subgrupos para la variable principal SG del segundo análisis intermedio (AI2):
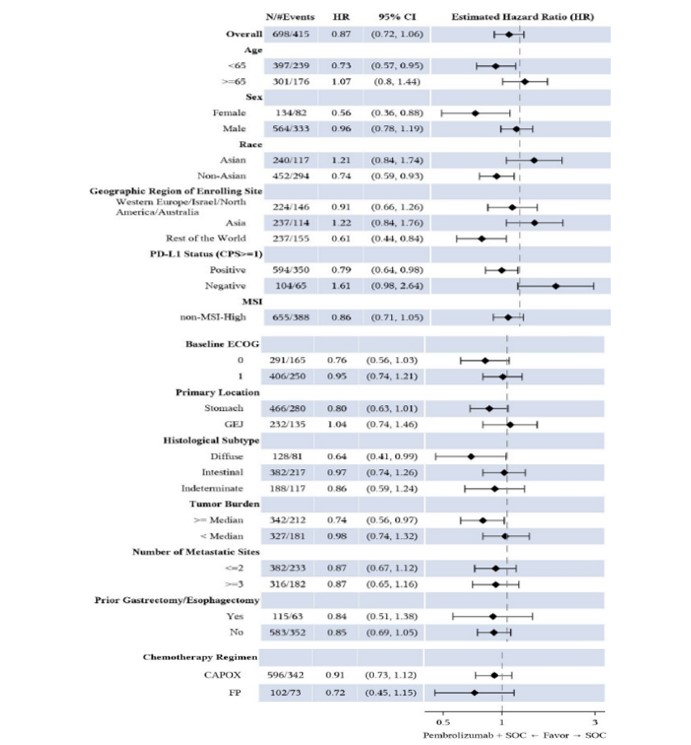
Figura 2. Diagrama de forest-plot de la HR de SG de subgrupos del AI2 (cohorte global. Población ITT)3.
Empleando la escala de la ESMO para valorar la relevancia del beneficio clínico (ESMO-MCBS), aplicada al subgrupo de pacientes con PD-L1 positivo y utilizando los resultados de SG del AI3, se obtuvo una puntuación de grado 3 (valoración propia), correspondiente a un beneficio clínico modesto. A pesar del resultado moderado, se podría considerar que una diferencia en SG de 4,3 meses, por diferencia de medianas, constituye un beneficio clínico adicional relevante y la evidencia que lo sostiene presenta una incertidumbre baja, si bien se añaden algunos efectos adversos.
En resumen:
- El ensayo pivotal, KEYNOTE, muestra beneficio significativo en SLP, pero no en SG, pendiente del análisis final para esta variable.
- El beneficio en SG mostrado por pembrolizumab en la subpoblación con PD-L1 positivo CPS≥1 (indicación autorizada) se considera clínicamente relevante.
- Para la subpoblación con PD-L1<1 no se demostró eficacia, por lo que se encuentra excluida de la autorización del tratamiento. El número de pacientes incluidos en el ensayo con PD-L1<1 fue bajo, representado por un 15% de pacientes en cada brazo de tratamiento. Teniendo en cuenta el análisis de subgrupos previamente comentado, está justificada la decisión de la EMA de restringir la indicación a los pacientes con PD-L1 positivo (CPS≥1).
- No existe evidencia en pacientes con ECOG≥2.
Seguridad
El 99,1% y 100% de los pacientes del grupo experimental y control respectivamente presentaron algún EA, de los cuales el 71% y 65% fueron de grado ≥3. Los principales efectos adversos inmunomediados fueron reacciones infusionales, hipotiroidismo, neumonitis y colitis. Por tanto, el perfil de seguridad de la combinación de pembrolizumab más SOC parece que refleja los perfiles de seguridad de la terapia estándar empleada y de la monoterapia con pembrolizumab. Debe prestarse especial atención a los efectos inmunomediados y a su seguimiento clínico establecido.
Coste
El CEI estimado para pembrolizumab más tratamiento estándar comparado con el estándar es de 100.931,10 €/año de vida ganado.
Propuesta de posicionamiento
El esquema de tratamiento de pembrolizumab, trastuzumab, fluoropirimidina y quimioterapia que contenga platino se propone como tratamiento en primera línea para el tratamiento de pacientes con ACG o UGE HER2 positivo localmente avanzado irresecable o metastásico que presenten las siguientes características:
| 1. Expresión de PD-L1 con un CPS≥1%.
2. PS (ECOG) 0-1. |
El tratamiento con trastuzumab, fluoropirimidina y quimioterapia que contenga platino seguirá siendo de elección en pacientes con PD-L1 CPS<1.
El tratamiento se prolongará hasta la progresión radiológica confirmada de la enfermedad o hasta un máximo de 35 ciclos. Se podrá considerar la suspensión del tratamiento en los pacientes que alcancen una respuesta completa confirmada, después de recibir al menos 8 administraciones en total y al menos 2 administraciones adicionales del tratamiento después de lograr la respuesta completa confirmada.
REFERENCIAS
(1) Agencia Europea del Medicamento. Assessment report. Keytruda (pembrolizumab) [en línea]. [Consultado el 25 de octubre de 2023] Disponible en: https://www.ema.europa.eu/en/documents/variation-report/keytruda-h-c-003820-ii-0133-epar-assessment-report-variation_en.pdf
(2) Janjigian YY, Kawazoe A, Bai Y, Xu J, Lonardi S, Metges JP, Yanez P, Wyrwicz LS, Shen L, Ostapenko Y, Bilici M, Chung HC, Shitara K, Qin SK, Van Cutsem E, Tabernero J, Li K, Shih CS, Bhagia P, Rha SY; KEYNOTE-811 Investigators. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet. 2023 Dec 9;402(10418):2197-2208. doi: 10.1016/S0140-6736(23)02033-0. Epub 2023 Oct 20. PMID: 37871604
(3) Seruga B, Pond GR, Hertz PC, et al. Comparison of absolute benefits of anticancer therapies determined by snapshot and area methods. Ann Oncol [en linea]. 2012;23(11):2977–82. [Consultado el 10 de diciembre de 2023]. Disponible en: http://dx.doi.org/10.1093/annonc/mds174
* Domínguez-Santana CM, Alegre-Del Rey E, Fénix-Caballero S. Pembrolizumab en combinación con trastuzumab, fluoropirimidina y quimioterapia que contenga platino para el tratamiento en primera línea de adenocarcinoma gástrico o de la unión gastroesofágica HER2 positivo localmente avanzado irresecable o metastásico. Informe para el Grupo GENESIS. Enero 2024. Disponible en: http://gruposdetrabajo.sefh.es/genesis/