RESUMEN/ASPECTOS DESTACADOS INFORME GENESIS*
La distrofia muscular de Duchenne (DMD) es una enfermedad de herencia recesiva ligada al cromosoma X que se caracteriza por debilidad muscular progresiva de inicio en la infancia. La exploración neurológica puede mostrar debilidad axial, signo de Gowers (Figura 1). A esto se le suman las complicaciones cardíacas o respiratorias que surgen con el tiempo y ocasionan discapacidad, dependencia y muerte prematura. Su manejo terapéutico es fundamentalmente sintomático y trata de mejorar la funcionalidad y la calidad de vida, paliar las complicaciones y prolongar la supervivencia.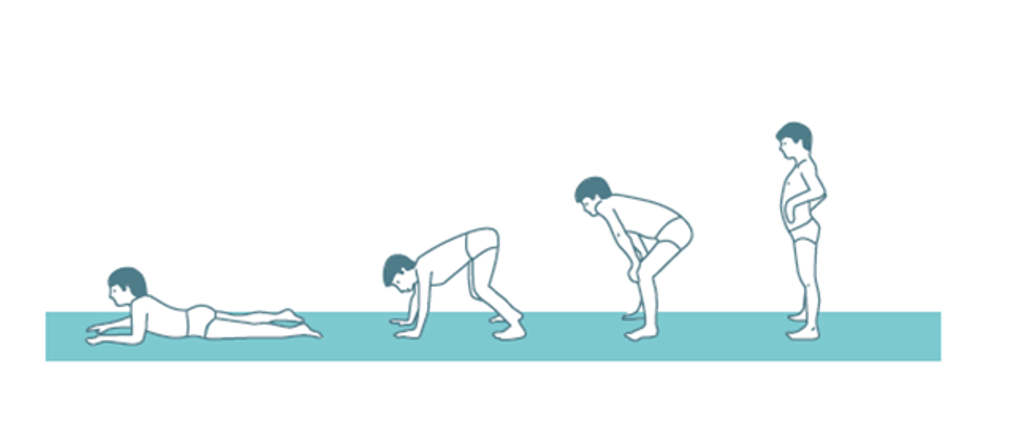
No se dispone de tratamiento curativo. La terapia se dirige principalmente hacia el mantenimiento de la fuerza muscular del paciente, la prevención del desarrollo de deformidades de la columna vertebral, el manejo de complicaciones respiratorias y la prevención y tratamiento de alteraciones cardíacas. El único tratamiento farmacológico que ha demostrado mejorar la progresión de la enfermedad son los corticoides. Otras terapias actualmente no financiadas en España son eteplirsen, atalureno y givinostat.
VAMOROLONA
Indicado para el tratamiento de la DMD en pacientes a partir de 4 años de edad. Es de administración vía oral. Es un corticosteroide disociativo que se une de forma selectiva al receptor de los glucocorticoides y desencadena efectos antiinflamatorios por medio de la inhibición de transcripciones de genes mediadas por el factor NF-kB, pero provoca una menor activación transcripcional de otros genes. Designado “medicamento huérfano” (EU/3/14/1309) en 22/08/2014 por la Comisión Europea.