Adelanto de informe GHEMA (Grupo Hospitalario Andaluz de Evaluación de Medicamentos). Los resultados completos se publicarán en el informe.
En junio de 2023, la Comisión Europea autorizó nivolumab con quimioterapia en neoadyuvancia para cáncer de pulmón no microcítico (CPNM) con PD-L1 ≥ 1%. Los resultados, potencialmente curativos, marcan un hito en el tratamiento del CPNM: un aumento de la supervivencia sin recaída a 2 años del 44% al 63% (HR 0,41, IC95 0,24-0,70), estudio CHECKMATE-816: un 19% más de pacientes libres de recaer1. El tratamiento no está aún financiado aunque, por la magnitud y relevancia clínica de los resultados, podría ser autorizado paciente a paciente en comisiones locales.
Aún pendiente de autorización, pembrolizumab, esta vez en neoadyuvancia con quimioterapia más adyuvacia en monoterapia, se ha estudiado en CPNM precoz, independientemente del PD-L12. El beneficio es también muy relevante, con aumento de la supervivencia sin recaída a 2 años del 40,6% al 62,4% (HR 0,58; IC95 0,46 a 0,72). En pacientes con PD-L1 ≥ 1%, el HR fue 0,47 (IC95 0,36-0,63). El diseño de este estudio (KEYNOTE-671), lo mismo que ocurrió con el estudio KEYNOTE-355 en cáncer de mama triple negativo, no permite valorar qué parte de beneficio añade seguir con la adyuvancia con pembrolizumab cuando ya se ha usado en neoadyuvancia.
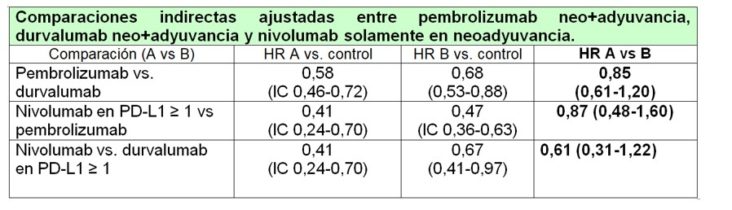
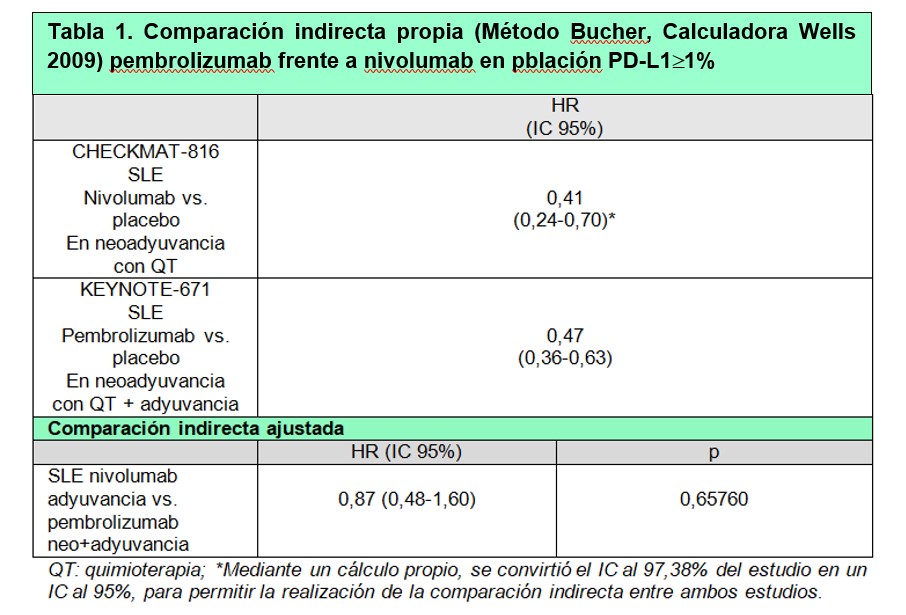
En este escenario, tiene mucho sentido acudir a una comparación indirecta ajustada de nivolumab en neoadyuvancia solamente vs. pembrolizumab en neoadyuvancia + adyuvancia. El diseño de los ensayos permite la comparación indirecta ajustada por el método de Bucher para los pacientes con PD-L1 > 1%. Los resultados pueden observarse en la tabla siguiente, disponible en un informe del Grupo Hospitalario Andaluz de Evaluación de Medicamentos (GHEMA).
En seguridad, la ventaja es clara para nivolumab por usarse en neoadyuvancia solamente, pues se ahorran las reacciones adversas del tratamiento en adyuvancia: 3 ciclos frente a 16 ciclos. Esto supone además una mayor adecuación, con menos molestias para los pacientes.
En cuanto al coste del tratamiento, este es mucho menor para nivolumab en adyuvancia: 6.925 € vs. 35.674 € con pembrolizumab en neo+adyuvancia. El impacto presupuestario en 3.351 pacientes anuales estimados en España con PD-L1 > 1%, se ha estimado en 23 millones para nivolumab en neoadyuvancia vs. 120 millones para pembrolizumab en neo + adyuvancia.
El estudio KEYNOTE-5512 en cáncer de mama triple negativo ya nos arrojaba dudas sobre el beneficio de añadir inmunoterapia en adyuvancia cuando ya se ha usado en neoadyuvancia, pero el diseño del estudio no permitía comprobarlo. En CPNM, la comparación indirecta sugiere que ese beneficio podría ser marginal, si es que existe. Sería obligatorio, viendo estos datos, establecer diseños de investigación que permitieran evaluar la contribución de la inmunoterapia en adyuvancia cuando ya se ha usado en neoadyuvancia. Con los resutados disponibles, por eficacia, seguridad, adecuación y coste, nivolumab en neoadyuvancia resulta preferible a pembrolizumab en neoadyuvancia + adyuvancia en pacientes con PD-L1 > 1%.
En pacientes con PD-L1 < 1%, pembrolizumab supone un beneficio claramente relevante, pero sería importante investigar, como se ha comentado, qué beneficio aporta seguir con la adyuvancia si ya se ha recibido previamente en neoadyuvancia. El estudio pivotal no permite saberlo.
REFERENCIAS
- EMA. Opdivo® (nivolumab). https://www.ema.europa.eu/en/medicines/human/EPAR/opdivo [acceso 19/1/2024].
- Wakelee H, Liberman M, Kato T,et al.; KEYNOTE-671 Investigators. Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer. N Engl J Med 2023;389(6):491-503.
- Pembrolizumab en neoadyuvancia y adyuvancia para CPNM (borrador). GHEMA 2023.