RESUMEN/ASPECTOS DESTACADOS INFORME GENESIS*
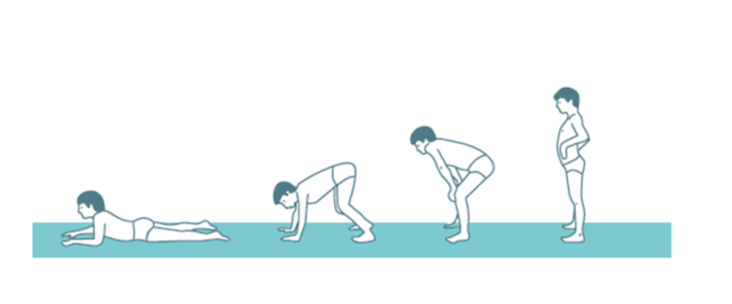
La distrofia muscular de Duchenne (DMD) es una enfermedad de herencia recesiva ligada al cromosoma X que se caracteriza por debilidad muscular progresiva de inicio en la infancia. La exploración neurológica puede mostrar debilidad axial, signo de Gowers (Figura 1). A esto se le suman las complicaciones cardíacas o respiratorias que surgen con el tiempo y ocasionan discapacidad, dependencia y muerte prematura. Su manejo terapéutico es fundamentalmente sintomático y trata de mejorar la funcionalidad y la calidad de vida, paliar las complicaciones y prolongar la supervivencia.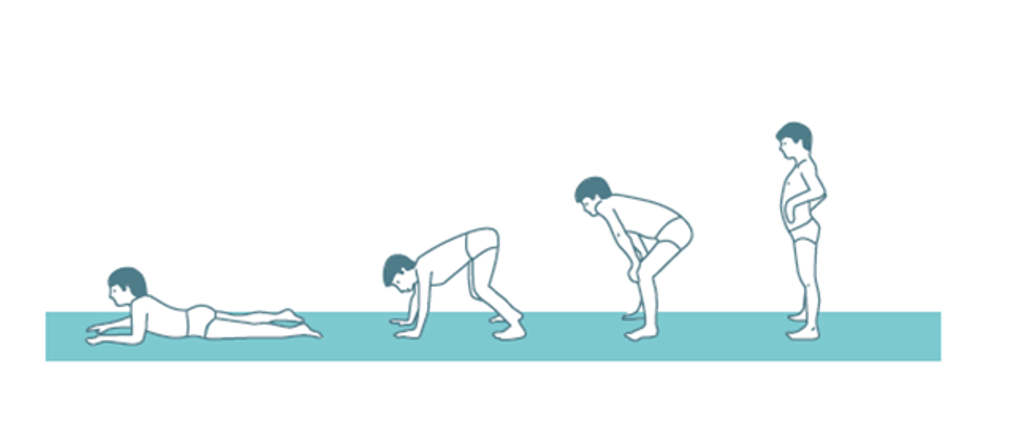
No se dispone de tratamiento curativo. La terapia se dirige principalmente hacia el mantenimiento de la fuerza muscular del paciente, la prevención del desarrollo de deformidades de la columna vertebral, el manejo de complicaciones respiratorias y la prevención y tratamiento de alteraciones cardíacas. El único tratamiento farmacológico que ha demostrado mejorar la progresión de la enfermedad son los corticoides. Otras terapias actualmente no financiadas en España son eteplirsen, atalureno y givinostat.
VAMOROLONA
Indicado para el tratamiento de la DMD en pacientes a partir de 4 años de edad. Es de administración vía oral. Es un corticosteroide disociativo que se une de forma selectiva al receptor de los glucocorticoides y desencadena efectos antiinflamatorios por medio de la inhibición de transcripciones de genes mediadas por el factor NF-kB, pero provoca una menor activación transcripcional de otros genes. Designado “medicamento huérfano” (EU/3/14/1309) en 22/08/2014 por la Comisión Europea.
Eficacia
La eficacia de vamorolona fue evaluada en el ensayo clínico VBP-004, un estudio multicéntrico, aleatorizado, doble ciego, de grupos paralelos, controlado con placebo y con control activo con prednisona, de 24 semanas de duración, seguido de una fase de extensión doble ciego hasta la semana 48.
En la primera parte del estudio (periodo 1), los pacientes se aleatorizaron a uno de los tratamientos siguientes:
- vamorolona 6 mg/kg/día (n = 30)
- vamorolona 2 mg/kg/día (n = 30)
- prednisona 0,75 mg/kg/día como comparador activo (n = 31)
- placebo (n = 30)
Tras 24 semanas, los pacientes que habían recibido prednisona o placebo se reasignaron, de acuerdo con un sistema de aleatorización inicialmente definido, a vamorolona 6 mg/kg/día o a vamorolona 2 mg/kg/día (período 2).
En el periodo 1, la variable primaria de medida de eficacia fue el cambio entre la situación basal y la semana 24 en la velocidad de la prueba cronometrada de levantarse del suelo (TTSTAND). Las variables secundarias clave fueron la prueba de la marcha de los 6 minutos (6MW) y velocidad en la prueba tiempo para completar corriendo/caminado 10 m de un recorrido de 14 m (TTRW) y las variables exploratorias velocidad en la prueba tiempo para subir 4 escalones (TTCLIMB) y la escala de evaluación funcional North Star (NSAA).
En el caso de vamorolona 6 mg/kg/día, se observaron mejoras en todas las variables de eficacia motora durante el periodo 1 y se mantuvieron durante el periodo 2 del estudio. Sin embargo, estas mismas variables medidas tras administrar vamorolona a 2 mg/kg/día no fueron consistentes en la semana 48.
Aunque en el EC pivotal se administró prednisona en un grupo de pacientes, el diseño no contemplaba la comparación entre vamorolona y prednisona. Por lo tanto, no se dispone de evidencia de equivalencia terapéutica en el momento actual, aunque se intuye una eficacia parecida.
Seguridad
Las reacciones adversas notificadas con más frecuencia tras la administración de vamorolona fueron: síntomas del síndrome de Cushing, vómitos, aumento del peso e irritabilidad. Estas reacciones, normalmente notificadas en los primeros meses de tratamiento, dependen de la dosis y tienden a disminuir o estabilizarse a lo largo del tiempo con un tratamiento continuo. Provoca la supresión del eje hipotálamo-hipofisario-suprarrenal, siendo la insuficiencia suprarrenal aguda (crisis suprarrenal) un efecto grave que puede producirse durante un período de aumento del estrés o si la dosis de vamorolona se reduce o se interrumpe bruscamente.
Adecuación
Vamorolona se presenta como suspensión oral de administración diaria. La terapia de referencia en esta patología son los corticoides orales, que se utilizan fuera de indicación.
Coste
Vamorolona todavía no está comercializado en España. Su coste como medicamento en situaciones especiales es de 5.550 € el envase de 100 mL (40 mg/mL). Con este precio, el coste anual del tratamiento para un paciente de 40 kg sería de 120.450 €. El impacto presupuestario nacional estimado es de unos 43 millones de €.
Limitaciones
- El estudio VBP-004 no se diseñó para mantener la tasa de error global de tipo I para las comparaciones de cada grupo de vamorolona frente a prednisona, por lo que los resultados se presentan como una evaluación global de las diferencias de tratamiento entre las variables, expresadas en un cambio porcentual respecto a la situación basal con intervalos de confianza del 95% para estos criterios de valoración.
- El uso en pacientes mayores de 7 años, no incluidos en los ensayos clínicos publicados, es una extrapolación debido a su semejanza en el mecanismo de acción de los corticoides.
- Las evidencias de seguridad y eficacia disponibles se limitan a un tiempo máximo de 30 meses y en pacientes que conservan la capacidad de deambulación.
- Sus efectos a largo plazo y en pacientes con mayor progresión de la enfermedad aún son desconocidos.
- Se excluyeron a los pacientes con miocardiopatía sintomática, siendo esta una complicación frecuente, lo que hace que los pacientes elegibles sean limitados.
- Al igual que pasa con el criterio que excluye aquellos pacientes que estuvieran en tratamiento con glucocorticoides o los hubieran recibido anteriormente de manera prolongada (superior a un mes acumulativo), ya que este es el tratamiento estándar utilizado en la DMD.
Conclusiones
- Vamorolona parece aportar una mejora en el perfil de seguridad óseo y de crecimiento de los pacientes con DMD en relación con los glucocorticoides, aunque está por definir la relevancia clínica de estos hallazgos.
- Sin embargo, su perfil de eficacia es similar a los corticoides, a falta de confirmación con estudios posteriores de comparación directa.
Condiciones de uso (propuestas en el informe):
- DMD confirmada por estudio génetico y con cuadro sintomático compatible.
- Que presenten efectos adversos inasumibles con los corticoides orales.
- Edad a partir de 4 años, con revisiones más periódicas a partir de los 7 años y fuera del rango (peso >13,0 kg y ≤ 39,9 kg) por falta de datos en este grupo en los ensayos clínicos.
- Que mantengan la capacidad de deambulación en el momento del inicio.
- Especial atención en los pacientes con cardiomiopatía sintomática, ya que sobre este grupo no se han realizado estudios.
- Previo inicio del tratamiento, comprobar calendario vacunal e inmunidad especialmente frente al virus de la varicela.
Plan de seguimiento:
Seguimiento estrecho del paciente, tanto por motivos de seguridad como de eficacia a corto y largo plazo. En caso de inclusión en guía farmacoterapéutica (GFT) se recomendaría monitorizar:
- Mejora clínicamente relevante en las puntuaciones NSAA, 6 MWTy tiempo en levantarse
- Alteraciones del comportamiento.
- Peso, talla e IMC.
- Hipertensión.
- Resistencia a la insulina.
- Supresión e insuficiencia suprarrenal.
- Fracturas.
Necesidades de investigación
- Se recomienda que se realicen ensayos clínicos comparativos de vamorolona con la terapia activa actual, corticoides orales.
- También sería una mejora significativa en la validez externa de los estudios, la inclusión de pacientes con miocardiopatía sintomática y con un rango de edad mayor, así como el estudio a largo plazo de estos pacientes, tanto en eficacia como en seguridad, más allá de los 30 meses estudiados hasta el momento.
- Si en futuro se dispone de tratamientos modificadores de la enfermedad, sería conveniente el estudio combinado con vamorolona.
REFERENCIAS
*Sanz-Rodríguez SM, Arocas-Casañ V. Vamorolona para el tratamiento de la distrofia muscular de Duchenne. Informe compartido del Grupo GENESIS- SEFH (revisor). Madrid: SEFH (ed.), [2024]. Disponible en: http://gruposdetrabajo.sefh.es/genesis/genesis/Enlaces/InformesHosp_abc.htm También en: http://gruposdetrabajo.sefh.es/genesis/