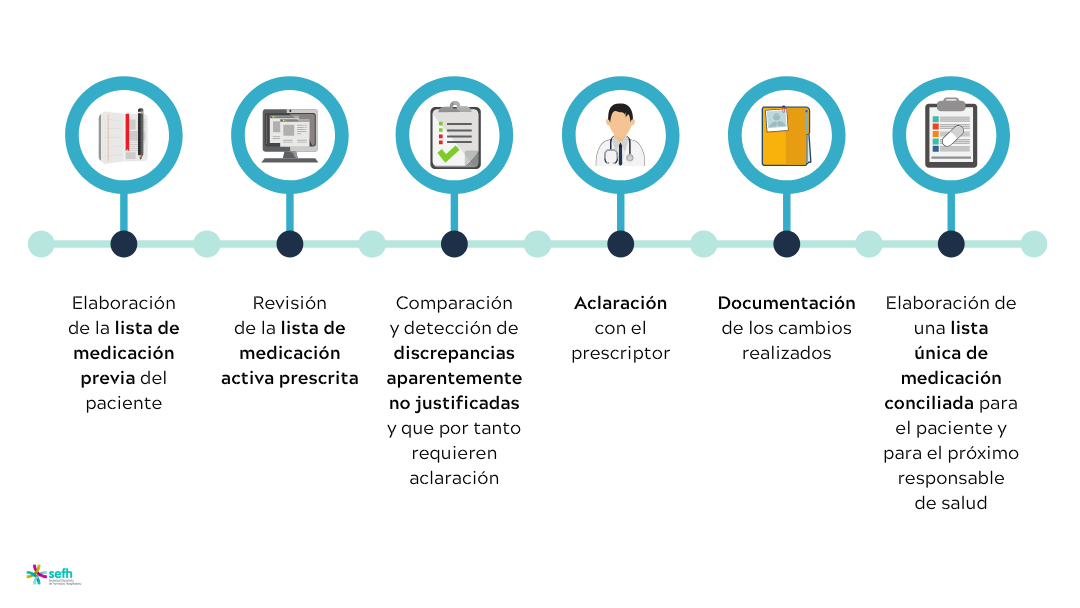
Paciente crónico, polifarmacia y transiciones asistenciales (Parte I): conciliación
By Grupos de trabajo de la SEFH - CRONOS y RedFastER
/
16 enero, 2020
Tanto los pacientes como los profesionales de la salud, jugamos un papel vital para garantizar la seguridad de los medicamentos....
Read More
Estadística con residentesSEFH (II): aleatorización o randomización
By Comite de Redacción de Residentes
/
13 noviembre, 2019
¿No tienes clara la importancia de la aleatorización en los ensayos clínicos? En el blog de residentes continuamos con las...
Read More
La innovación, una competencia profesional a desarrollar por los farmacéuticos de hospital
By SEFH
/
29 octubre, 2019
Entrevistamos a los miembros del grupo de trabajo que lideran el Foro de Innovación Hace unas semanas, José Manuel Martínez...
Read More
64 Congreso SEFH (III): Guía de ocio
By 64 Congreso SEFH
/
11 octubre, 2019
Siendo una de las ciudades más visitadas de España, no puedes dejar pasar la oportunidad de conocer Sevilla en este...
Read More
64 Congreso SEFH (II): ¡Completa tu experiencia somosSEFH con la app oficial del Congreso!
By 64 Congreso SEFH
/
3 octubre, 2019
Ya se encuentra disponible para su descarga la nueva app del 64 Congreso SEFH, con la que podrás mejorar tu...
Read More
Innovar para construir un futuro mejor
By José Manuel Martínez Sesmero
/
26 septiembre, 2019
Bien pudiera ser un interesante y atractivo comienzo de esta entrada (o post) evocar en la mente del lector avezado...
Read More
Los residentes preguntan… Entrevista a Eduardo Echarri: ¿Qué aporta un Farmacéutico/a en Salud Mental?
By Comite de Redacción de Residentes
/
8 agosto, 2019
¡Hola compañeros! Seguimos con la línea del blog de residentes “Los residentes preguntan…” en la que entrevistamos a farmacéuticos de...
Read More
64 Congreso SEFH (I): ¿Por qué hay que asistir al Congreso de la SEFH de 2019?
By 64 Congreso SEFH
/
1 agosto, 2019
Muy buenas a todos, compañeros Ya queda menos para celebrar el 64 Congreso de la SEFH (17-19 de octubre de...
Read More